Почта россии нормативные документы: Нормативные документы | Услуги и тарифы
Содержание
Разработка и внедрение автоматизированной информационной системы управления заказом (АИС УЗ) ФГУП «Почта России» — GlobalCIO|DigitalExperts
2018-11-02
- Заказчик
- ФГУП «Почта России»
- Руководитель проекта со стороны заказчика
Петр Марютин
Руководитель Департамента развития и сопровождения продуктов 1С
- ИТ-поставщик
- ООО «Аксиома-Софт»
- Год завершения проекта
- 2018
- Сроки выполнения проекта
- Июль, 2018 — Декабрь, 2018
- Масштаб проекта
- 8544 человеко-часов2000 автоматизированных рабочих мест
- Цели
Проект выполняется с целью автоматизации рабочих процессов исполнения функций по сбору потребностей со всех структурных подразделений ФГУП «Почта России», подготовке, проведению и учету закупок на поставку товаров, выполнение работ, оказание услуг в полном соответствии с нормативно-правовой документацией, обеспечение возможности сбора, контроля и анализа информации о закупочной деятельности подразделений Заказчика.

Уникальность проекта
ФГУП «Почта России» специфическая коммерческая структура — имеет статус федерального почтового оператора, предоставляет услуги почтовой связи на всей территории Российской Федерации, в том числе универсальные услуги почтовой связи по единым социально-ориентированным тарифам, регулируемым государством. В составе Предприятия работают 10 макрорегионов, порядка 87 филиалов, около 800 почтамтов, около 42 тыс. отделений почтовой связи. целевое кол-во пользователей 6500 человек. на данном этапе развития проекта кол-во пользователей составляет 2000 человек, за 4 месяца была автоматизированна и введена в промышленную эксплуатацию подсистема Планирования закупочной деятельности, успешно настроена интеграция с ЕИС и ЭТП. Была проведена оперативная доработка под вступившие в силу изменения по 223 ФЗ и новые принятые нормативные документы ФГУП «Почты России» регламентирующие закупочную деятельность.
- Проект решает задачи импортозамещения
- Нет
- Использованное ПО
Для решения задачи автоматизации закупочной деятельности ФГУП «Почта России» было выбрано флагманское решение фирмы 1С — «1С:Управление холдингом 8».
 Платформа: 1С:Предприятие 8.3 организована по типу архитектуры клиент-сервер.
Платформа: 1С:Предприятие 8.3 организована по типу архитектуры клиент-сервер.Проектирование системы базируется на принципах:
принцип развития (открытости) — не нарушая функционирования системы были внесены изменения по новым НЛА;принцип современности — при создании системы реализованы информационные интерфейсы для успешной интеграции с внешними системами. принципы стандартизации, многоуровневости, а так же санкционированного доступа к информации.
Состоит из следующих компонентов:
- кластер серверов приложений 1С
- сервера СУБД
- сервера файлового хранилища.
Система АИС УЗ взаимодействует с внутренними пользователями, служебными системами и прикладными системами Предприятия в корпоративной среде передачи данных (КСПД).
Сопровождение системы проиходит в соответствии с ITIL, версии 3 (с учетом обновлений 2011 г.).
- Описание проекта
Проект рассчитан до июня 2019 года.
 На данном этапе произведена автоматизация закупочной деятельности в части годового планирования в соответствии с 223 ФЗ и ЛНА Предприятия.
На данном этапе произведена автоматизация закупочной деятельности в части годового планирования в соответствии с 223 ФЗ и ЛНА Предприятия.Включая:
- автоматизацию процесса сбора заявок на закупку
- согласование документов в соответствии с ЛНА Предприятия
- интеграция и публикация на ЕИС
- возможность проведения централизованных и многолотовых закупок
- проведение закупочных процедур на ЭТП СБ АСТ, ЕЭТП
- произведено внедрение на всех уровнях Предприятия
- позволило улучшить управляемость и прозрачность процесса, выстроить единую систему проведения закупочной деятельности на всех уровнях предприятия без отрыва от рабочего процесса предприятия.
- География проекта
- на всей территории РФ.
фильтр
2022371
2021363
2020337
2019216
2018283
2017151
2016130
2015136
Предметная область
ERP-системы280
ITSM9
CRM-системы80
ECM-системы95
Бизнес-приложения (BPM,PLM,ToИР)252
Аналитические решения и большие данные140
Сервисы76
Создание и модернизация инфраструктуры200
Облачные среды52
Отечественная разработка213
Импортозамещение20
Мобильные решения75
AI/RPA/IoT44
Аутсорсинг18
IoT и RPA7
DataScience / Blockchain4
Информационная безопасность39
Порталы58
Видеонаблюдение и системы распознавания образов20
Виртуализация7
Образовательные сервисы15
ЦОД и СХД10
Другое51
Отрасль
Госуправление/НКО118
Оптовые продажи20
Поставщик ИТ-оборудования и услуг35
Производство (машиностроение/оборудование)155
Производство FMCG (потребительские товары)108
Топливно-энергетический комплекс187
Химия и нефтехимия38
Банки/Инвестиции/Страховые компании259
Розничная торговля/E-commerce164
Транспорт и логистика147
Медицина и фармацевтика74
Туризм/Гостиницы/Рестораны23
Образование/Наука48
Искусство/Культура/СМИ31
Спорт15
Строительство/Недвижимость61
Металлургия и непрерывное производство74
Другое143
Управление
Управление цифровой трансформацией (CDTO)81
Управление ИТ (CIO)170
Безопасность (CSecO)27
Финансы (CFO)150
HR (HRD)69
Продажи (CSO)105
Маркетинг (CMO)36
Производство (СPO)199
Руководство компанией (CEO)57
Закупочная деятельность22
Управление логистикой (CLO)60
Другое144
Министерство труда и социальной защиты населения Забайкальского края
08. 10.2020, 09:31
10.2020, 09:31
| Регистрационный номер учетной записи | 7571 |
| Дата
включения в реестр поставщиков | 01.10.2020 |
| Полное наименование поставщика социальных услуг | Акционерное общество «Почта России» Управление Федеральной почтовой связи Забайкальского края |
| Сокращенное наименование поставщика социальных услуг | АО «Почта России» УФПС Забайкальского края |
| Дата государственной регистрации | |
| Организационно-правовая форма | акционерное общество |
| Учредители | Российская Федерация |
| Адрес
местонахождения | 672000, Забайкальский край, г. Чита, Ул. Ленина, 10 |
| Адрес
предоставления социальных услуг | На территории Читинского, Шилкинского и Тунгокоченского районов Забайкальского края |
| Контактный телефон | 8-3022-26-88-77 |
| Адрес электронной почты | office-R75@russianpost. ru ru |
| График
работы | |
| Структура
учреждения | |
| ФИО
руководителя, заместителей руководителя | Рыхлов Евгений Валентинович |
| Персональный
состав работников | |
| Информация о лицензиях | |
| Информация
о материально-техническом обеспечении предоставления социальных услуг | |
| Сведения о формах социального обслуживания | социальные услуги на дому |
| Перечень предоставляемых социальных услуг по формам социального обслуживания и видам социальных услуг | 1) социально-бытовые; 2) социально-медицинские |
| Тарифы на предоставляемые социальные услуги по формам социального обслуживания и видам социальных услуг | скачать |
| Информация об общем количестве мест | |
| информация о количестве свободных мест | |
| Информация
о порядке и условиях предоставления социальных услуг | |
| Объем
предоставляемых социальных услуг за счет средств бюджета Забайкальского края | |
| Объем
предоставляемых социальных услуг за счет средств физических и (или) юридических лиц | |
| Информация о проверках | проверки в отношении поставщика СУ не проводились |
| Адрес официального сайта | www. pochta.ru pochta.ru |
Публикация Положения о санкциях РФ в отношении вредной иностранной деятельности
Начало Преамбула
Управление по контролю за иностранными активами, Казначейство.
Публикация определения.
Управление по контролю за иностранными активами Министерства финансов (OFAC) публикует постановление о продуктах, изданное в соответствии с указом президента от 11 марта 2022 года. Решение было ранее опубликовано на сайте OFAC.
Определение в соответствии с разделом 1(a)(i) Распоряжения № 14068 было издано 24 июня 2022 г. См.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
для дополнительных соответствующих дат.
Начать дополнительную информацию
OFAC: помощник директора по лицензированию, 202-622-2480; помощник директора по вопросам регулирования, 202-622-4855; или помощник директора по соблюдению и оценке санкций, 202-622-2490.
Конец дополнительной информации
Конец преамбулы
Начать дополнительную информацию
Электронная доступность
Этот документ и дополнительная информация об OFAC доступны на веб-сайте OFAC:
www.treas.gov/ofac.
Фон
11 марта 2022 года Президент, ссылаясь на полномочия,
в том числе,
Закон о международных чрезвычайных экономических полномочиях (50 U. S.C. 1701
S.C. 1701
и след. ), издано Исполнительное распоряжение (E.O.) 14068 (87 FR 14381, 15 марта 2022 г.). Среди других запретов раздел 1(a)(i) E.O. № 14068 запрещает ввоз в США следующих продуктов российского происхождения: рыбы, морепродуктов и продуктов из них; спиртные напитки; непромышленные алмазы; и любые другие продукты российского происхождения, которые могут быть определены министром финансов после консультации с государственным секретарем и министром торговли.
24 июня 2022 г. в соответствии с делегированными полномочиями директор OFAC в консультации с Государственным департаментом и Министерством торговли определил, что запреты в разделе 1(a)(i) E.O. 14068 распространяется на золото российского происхождения. Решение вступило в силу после публикации на сайте OFAC (
www.treas.gov/ofac ) от 28 июня 2022 г. Текст определения приведен ниже.
УПРАВЛЕНИЕ ПО КОНТРОЛЮ ЗА ИНОСТРАННЫМИ АКТИВАМИ
Определение в соответствии с разделом 1(a)(i) Исполнительного указа 14068
Запреты на ввоз золота российского происхождения
В соответствии с разделами 1(а)(i), 1(b) и 5 Распоряжения Правительства РФ 14068 от 11 марта 2022 г. («Запрет на ввоз некоторых Экспорт и новые инвестиции в связи с продолжающейся агрессией Российской Федерации») и 31 CFR 587.802, Директор Управления по контролю за иностранными активами, в консультации с Государственным департаментом и Министерством торговли, настоящим определяет, что запреты в разделе 1 (a)(i) Е.О. 14068 распространяется на золото российского происхождения. В результате ввоз в Соединенные Штаты золота российского происхождения запрещен, за исключением случаев, предусмотренных законом, или без лицензии или иного разрешения Управления по контролю за иностранными активами.
(«Запрет на ввоз некоторых Экспорт и новые инвестиции в связи с продолжающейся агрессией Российской Федерации») и 31 CFR 587.802, Директор Управления по контролю за иностранными активами, в консультации с Государственным департаментом и Министерством торговли, настоящим определяет, что запреты в разделе 1 (a)(i) Е.О. 14068 распространяется на золото российского происхождения. В результате ввоз в Соединенные Штаты золота российского происхождения запрещен, за исключением случаев, предусмотренных законом, или без лицензии или иного разрешения Управления по контролю за иностранными активами.
Это определение не включает золото российского происхождения, которое находилось за пределами Российской Федерации до даты вступления в силу этого определения.
Настоящее определение вступает в силу после публикации Директором Управления по контролю за иностранными активами на веб-сайте Министерства финансов.
Начальная подпись
Конечная подпись
Конец дополнительной информации
[Док. 2022-20030 Подано 14.09.22; 8:45]
2022-20030 Подано 14.09.22; 8:45]
КОД СЧЕТА 4810-AL-P
рынок | Положение о медицинских изделиях в России и Евразийском Союзе
Опубликовано Алексей Степанов
- Обязательное уведомление обо всех ввозимых медицинских изделиях с 1 марта st , 2022
1 марта st , 2022 г. – дата вступления в силу Положения № 11020 (ссылка на русском языке), устанавливающего обязательные требования к уведомлению за каждую единицу любого медицинского изделия, ввозимого в Россию, а также произведенного внутри страны.
Согласно регламенту, это уведомление должно быть выполнено в целях контроля безопасности со стороны регулирующих органов. Это должен сделать производитель, его уполномоченный представитель или импортер медицинского изделия. Информация о наименовании медицинского изделия и его модификации, серийном номере, дате изготовления и годности, номере и дате регистрации должна быть предоставлена с использованием электронной системы Росздравнадзора в течение пятнадцати дней с момента ввоза или выпуска изделия в производство.
2. Новое руководство по требованиям к системе менеджмента качества при регистрации медицинских изделий
9 февраля , 2022 г. Правительство Российской Федерации выпустило постановление № 135 (ссылка на русском языке) и установило правила проверки качества системы управления производителями медицинского оборудования. Документ вводит обязательные требования по представлению отчетов о проверке СМК по национальным процедурам для внесения изменений в регистрационные удостоверения с 19 июня.0067-ст , 2023, и содержит подробные рекомендации по организации аудита СМК.
Кроме того, 18 февраля 2022 г. Минздравом России выпущено постановление № 91Н «О методах определения размера платы за оказание услуг, связанных с проверкой производства медицинских устройства. Документ предоставляет инструменты для расчета необходимых человеческих ресурсов и затрат на проверку систем менеджмента качества для регистрации медицинских изделий.
Согласно документу, максимальная стоимость инспекции ограничена 1,274 млн рублей с учетом НДС для российских производителей (около 13 000 долларов США) и 2,729 млн рублей для иностранных производителей (около 28 000 долларов США).
3. Новые рекомендации по проведению доклинических и клинических испытаний медицинских изделий в России
1 марта ст , 2022 г., также является датой вступления в силу Постановления № 885Н в новой редакции руководств по технической оценке, токсикологическим испытаниям и клиническим испытаниям в рамках процедуры национальной регистрации медицинских изделий. Положение заменит положение № 2Н (ссылка на русском языке), действовавшее с 2014 года.
Напомним, возможность возобновления подачи заявок по национальным правилам регистрации еще на один год обсуждалась с конца декабря 2021 года. Однако по состоянию на конец февраля 2022 года это оставалось невозможным.
Опубликовано на английском языке
|
Метки: Клинические испытания, послепродажное обслуживание, qms
|
1 Ответить
Опубликовано Алексей Степанов
- Подача заявок в соответствии с локальными нормативными актами на медицинские изделия государств-членов Евразии закрыта, но может быть открыта повторно
переходный период регистрации устройств с национального на евразийский уровень.
30 декабря 2021 г. Евразийская экономическая комиссия (ЕЭК) выпустила настоящий протокол (ссылка на русском языке), подтверждающий переход и необходимость рассмотрения всех регистрационных досье, поданных до 31 декабря 2021 г., в соответствии с первоначальными правилами. Протокол также подтвердил, что все медицинские изделия, одобренные локально в государствах Евразии до 31 декабря 2021 года, могут сохранить свой статус в государстве-члене до истечения срока их регистрации. Регистрации также могут быть изменены в соответствии с национальными правилами, которые действуют до 31 декабря 2026 года9.0003
В январе 2022 года российский регулятор медицинских изделий Росздравнадзор объявил о прекращении подачи регистрационных файлов новых устройств, соответствующих исходным национальным правилам. Регуляторы медицинских устройств также опубликовали аналогичную информацию в Казахстане и Беларуси.
Регуляторы медицинских устройств также опубликовали аналогичную информацию в Казахстане и Беларуси.
Однако 24 декабря 2021 года ЕЭК обсудила новые изменения к соглашению, возможное возобновление подачи заявок и продление переходного периода еще на год. 19 января 2022 года ЕЭК опубликовала Постановление № 27 (ссылка на русском языке), утверждающее это продление, которое должны санкционировать все евразийские государства-члены.
Кроме того, в конце декабря 2021 г. ЕЭК выпустила две поправки к действующим евразийским регламентам по медицинским изделиям: Регламент 144, редакция правил ЕАЭС по регистрации и экспертизе изделий (ссылка на русском языке), и Регламент 146, новая редакция руководства по клиническим исследованиям (ссылка на русском языке).
На конец января 2022 года в евразийской базе данных по новым требованиям осталось 7 медицинских изделий, тогда как российский Регулятор говорил о сотнях новых заявок в день по национальным требованиям на конец 2021 года и более 31 тысяч медицинских устройств, одобренных по «старому подходу».
- Ближайший Срок подачи отчетов о клиническом мониторинге в России
В соответствии с положением 1113, вступившим в силу в январе 2021 г., клинический пострегистрационный мониторинг требуется для медицинских изделий класса III и IIB имплантируемые устройства, зарегистрированные в России после января 2021 года. В регламенте также указано, что устройства должны находиться под постоянным контролем, с ежегодными отчетами о мониторинге в течение трех лет после даты утверждения. Указания по структуре и содержанию отчетов приведены в приложении 5 к регламенту.
Крайний срок подачи первых отчетов – 1 февраля 2022 года.
21 января 2021 года Росздравнадзор опубликовал памятку для производителей медицинских изделий (ссылка на русском языке) и разъяснил требования к представлению отчетов на бумажном носителе.
3. Продление процедуры ускоренной регистрации медицинских изделий для диагностики и лечения COVID-19
COVID-19диагностическая и лечебная продукция.
В соответствии с постановлением 430 (ссылка на русском языке) более 400 таких медицинских изделий могут быть одобрены в рамках ускоренной процедуры оценки с ограниченным сроком годности для конкретной партии.
Срок действия более 500 существующих регистрационных удостоверений в национальной базе данных, выданных по этому маршруту, был продлен с 1 января 2022 года до 1 января 2025 года;
В январе 2022 года российский регулятор подтвердил возможность подачи этих регистрационных файлов с использованием российских национальных (но не евразийских) критериев.
***
Спасибо, что следите за моим блогом, целью которого является предоставление своевременных и четких обновлений о развитии российских и евразийских правил медицинского оборудования. Вас также может заинтересовать моя недавняя статья о евразийской модели регулирования медицинских устройств, которая будет опубликована в Journal of Medical Device Regulation в феврале 2022 года.
Опубликовано на английском языке
|
Метки: COVID-19, EAC, постмаркет, Регистрация
|
Оставьте ответ
Опубликовано Алексей Степанов
Уважаемые коллеги,
Приветствую вас в моем ежемесячном обзоре изменений в законодательстве, касающемся медицинских изделий в России и Евразийском регионе.
- Евразийский переход менее чем через месяц
Менее чем через месяц завершится переходный период и вступит в силу полный переход на евразийские правила обращения с медицинскими изделиями. Заявки на регистрацию медицинских изделий по национальным требованиям для России, Беларуси и Казахстана будут закрыты. С 1 января 2022 года все медицинские изделия должны быть зарегистрированы исключительно в соответствии с законодательством Евразийского экономического союза (ЕАЭС).
После пятилетнего переходного периода получен очень ограниченный практический опыт работы в соответствии с новыми требованиями: По состоянию на ноябрь 2021 года Евразийская комиссия (ЕЭК) числила в своем официальном реестре семь разрешенных медицинских изделий и более 30 заявок в настоящее время находятся на рассмотрении евразийских государств-членов.
Напомним, что Регламентом Евразии № 142 от сентября 2019 г., Регламентом Евразии № 20 от 21 октября 2021 г. и Регламентом РФ № 2081 от июля 2021 г. установлены следующие требования: для этого перехода:
— Подача заявок на регистрацию и экспертизу медицинских изделий (в соответствии с национальной процедурой в России, Беларуси, Казахстане и Кыргызстане) разрешена до 31 декабря 2021 года. может сохранить этот статус в государстве-члене до истечения срока регистрации с возможностью внесения изменений в соответствии с национальными правилами, действующими до 31 декабря 2026 года.
В случае подачи до 31 декабря 2021 года регистрационное досье будет рассмотрено местные правила регистрации соответствующего государства-члена.
По состоянию на конец ноября 2021 г. никаких других официальных обновлений об изменениях, расширениях или исключениях из требований не публиковалось. Однако требования также должны быть ратифицированы всеми евразийскими государствами-членами.
2. Обязательное уведомление о всех ввозимых в Россию медицинских изделиях
25 ноября 2021 года Минздрав России опубликовал приказ № 11020 (ссылка на русском языке) и установил с 1 марта 2022 года обязательные требования к уведомлению о каждом единица любого медицинского изделия, ввозимого в Россию или производимого внутри страны в целях контроля безопасности со стороны регулирующего органа. Согласно документу, информация о наименовании медицинского изделия и его модификации, серийном номере, дате изготовления и истечения срока годности, номере и дате регистрации должна быть предоставлена с использованием электронной системы Росздравнадзора в течение пятнадцати дней. после ввоза или производства.
3. Требования к отдельным продуктам для диагностики in vitro
2 ноября 2021 г. опубликован Приказ Минздрава России № 1031Н, которым утвержден порядок изготовления, хранения и утилизации некоторые медицинские устройства для диагностики in vitro (IVD) (т. е. анализы IVD «собственного/домашнего производства»), разработанные и изготовленные отдельными лабораториями.
е. анализы IVD «собственного/домашнего производства»), разработанные и изготовленные отдельными лабораториями.
Напомним, согласно принятым в июле 2021 года нормативным документам, некоторые продукты могут проходить ускоренную процедуру одобрения для получения специального пятилетнего разрешения на клиническое/диагностическое использование, в частности лабораториями без регистрации продукта.
Опубликовано на английском языке
|
Tagged EAC, IVD, постпродажный
|
1 Ответить
Опубликовано Алексей Степанов
Уважаемые коллеги,
Вот моя обычная подборка основных моментов нормативных обновлений медицинских изделий в России за последний месяц:
1. Внедрение новых мер пострегистрационного контроля медицинских изделий в России
30 июля 2021 года Правительство Российской Федерации издало Постановление 1066 (ссылка на русском языке) и ввело в действие новые нормативные акты, которые существенно изменили меры контроля для организаций, осуществляющих оборот медицинских изделий в России (включая производителей, дистрибьюторов и заказчиков [медицинские центры]) .
Документом внесены изменения в формы и графики проведения контрольных проверок регулирующим органом. Плановые проверки будут проводиться каждые 4-6 лет, в зависимости от классификации риска организации, и не понадобятся для организаций из групп низкого риска.
В дополнение к плановым проверкам документом введены дополнительные меры контроля, такие как инспекционные визиты, контрольные закупки и выборочные проверки медицинских изделий.
2. Актуальная информация о требованиях к системе менеджмента качества для производителей медицинских изделий
В июле 2021 года Правительство Российской Федерации опубликовало два проекта руководящих указаний по требованиям к системе менеджмента качества (СМК) для производителей медицинских изделий.
Проект положения «О требованиях к внедрению, поддержанию и оценке системы менеджмента качества медицинских изделий в зависимости от их классификации риска» (ссылка на русском языке) содержит описание области оценки СМК, включая проектирование и разработку, процессы для управления документами и записями, процессов окончательной проверки, корректирующих и предупреждающих действий, а также процессов, связанных с клиентами.
Документ ссылается на российский стандарт ГОСТ ИСО 13485-2017 и Евразийское решение №106 в качестве руководства по внедрению СМК.
Еще один документ, опубликованный в июле 2021 года, — проект положения о проведении проверок СМК производителей медицинских изделий (ссылка на русском языке).
Опубликованное руководство предусматривает различие между тремя типами аудитов СМК:
1. Первоначальные проверки СМК, которые должны быть выполнены для всех производственных площадок, указанных в заявке на регистрацию.
2. Плановые регулярные проверки СМК, которые должны проводиться каждые 5 лет на производственных площадках, выбранных регулирующим органом.
3. Внеплановые проверки СМК, которые необходимо проводить в отдельных случаях внесения изменений в регистрацию или после выполнения корректирующих действий.
В проекте документа представлена матрица оценки значимости замечаний, зафиксированных в ходе проверки, которая по правилам должна быть закрыта в течение 30 дней после проверки.
В документе также приведены рекомендации по расчету продолжительности аудиторской проверки, которая может варьироваться от 6 до 13 дней в зависимости от численности персонала производственной организации. Однако весь процесс проверки не может превышать 90 дней с момента подачи заявки.
Есть несколько случаев, когда нормативные документы позволяют проводить аудит СМК дистанционно, при условии проведения выездного аудита в течение 2 лет
3. Новые нормативные требования к некоторым методам диагностики in-vitro на дому
На 15 Июль 2021 г. Министерство здравоохранения России опубликовало проект постановления (ссылка на русском языке), описывающего новые потенциальные способы утверждения, а также нормативные требования к некоторым продуктам для диагностики in vitro (IVD) (т. анализы IVD), разработанные и изготовленные отдельными лабораториями.
В соответствии с проектом нормативных документов такая продукция может проходить ускоренную процедуру одобрения путем получения специального разрешения сроком на 5 лет для клинического/диагностического применения в отдельных лабораториях без регистрации. Документ содержит подробное описание процедуры согласования и требований к подаче пакета заявок.
Документ содержит подробное описание процедуры согласования и требований к подаче пакета заявок.
Ожидается, что процедура применима к изделиям для диагностики in vitro, не имеющим зарегистрированного аналога в России, как произведенным, так и предназначенным для использования конкретной лабораторией или организацией, и будет учитывать оценку финансовых затрат на регистрацию и любую существующую потребность в диагностике с использованием изделия.
Опубликовано на английском языке
|
Метки: IVD, постмаркет, qms
|
1 Ответить
Опубликовано Алексей Степанов
Уважаемые коллеги,
Ниже представлена моя обычная подборка последних обновлений нормативных документов на медицинские изделия в Евразийском экономическом союзе (ЕАЭС):
- Обновления к Перечню Евразийских стандартов на медицинские изделия
8 июня 2021 года Евразийская экономическая комиссия опубликовала рекомендацию № 10 и обновила Евразийский перечень стандартов, подтверждающих соблюдение основных принципов безопасности и эффективности медицинских изделий в ЕАЭС.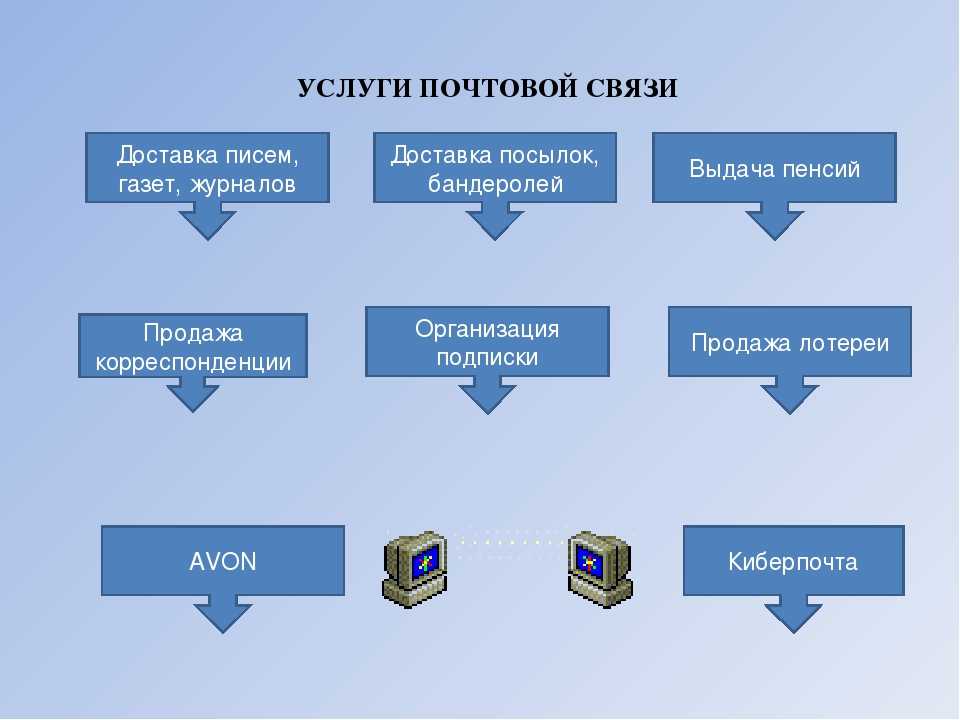
Согласно опубликованному документу, девять существующих стандартов были заменены более современными версиями; добавлено восемь новых стандартов и одна методика измерений, а семь устаревших стандартов исключены из текущей версии перечня.
Перечень применимых стандартов, обеспечивающих соблюдение основных принципов безопасности и эффективности медицинских изделий в ЕАЭС, является евразийским регламентом «третьего уровня». Первоначально он был опубликован в 2017 году и предназначался для гармонизации существующих национальных стандартов евразийских государств-членов и соотнесения их с соответствующими требованиями Основного перечня для добровольного использования производителями и испытательными лабораториями в процессе евразийской регистрации.
- Классификация нежелательных явлений медицинских изделий в России
В конце мая 2021 года Росздравнадзор издал приказ 4513 (ссылка на русском языке) и ввел классификацию нежелательных явлений, связанных с обращением медицинских изделий.
Классификация содержит 27 групп и характеризует каждое из неблагоприятных явлений, которые могут возникнуть (механические, химические, оптические проблемы, несоответствие совместимости, соединение, взаимодействие с внешней средой и т. д.).
Следует помнить, что российские правила обращения с медицинскими изделиями требуют мониторинга и отчетности о нежелательных явлениях, связанных с медицинскими изделиями, которые происходят как в России, так и в других странах.
- Изменения в налоговом законодательстве для отдельных групп медицинских изделий в России
1 июня 2021 года Правительство Российской Федерации опубликовало Постановление 851 (ссылка на русском языке) и обновило перечень медицинских изделий, облагаемых налогом по пониженной ставке 10 %, утвержден Постановлением Правительства РФ N 688. Согласно опубликованному документу, в этот перечень были включены, в частности, питательные среды in vitro, контейнеры для медицинских отходов, специальные урологические приборы и медицинская одежда.
Позже, 25 июня 2021 года, Минфин России дал разъяснения по применению налоговых преференций при реализации медицинских изделий после перехода на евразийскую систему. Согласно опубликованному письму (ссылка на русском), реализация медицинских изделий по сниженной ставке налога с использованием российского регистрационного удостоверения будет возможна до 31 декабря 2021 года. Однако, согласно тому же документу, Минздрав уже подготовил проект федерального закона об отмене указанного ограничения.
***
Спасибо, что следите за моим блогом, целью которого является предоставление своевременных и четких обновлений о развитии российских и евразийских правил медицинского оборудования. Вас также может заинтересовать мой предстоящий семинар на эту тему, запланированный на июль 2021 года.
Опубликовано на английском языке
|
Tagged EAC, постпродажный, НДС
|
Оставьте ответ
Опубликовано Алексей Степанов
Уважаемые коллеги,
Приветствую вас в моем ежемесячном обзоре наиболее важных обновлений регулирования медицинских изделий в России и Евразии.
1. Новые российские процедуры ввоза образцов медицинских изделий
С 1 января 2021 г. Росздравнадзор ввел в действие новые процедуры ввоза образцов для регистрации медицинских изделий в соответствии с Положением № 661н (ссылка на русском языке) . Отныне разрешение на ввоз требуется как для оформления, так и для процедуры продления, а документы подаются только в электронном виде.
По-прежнему не требуется разрешение на ввоз для ускоренной регистрации медицинских изделий и изделий in vitro, предназначенных для профилактики и лечения коронавируса в соответствии с постановлением № 430.
2. Новые требования послепродажного обслуживания медицинских изделий в России и Казахстане
В январе 2021 года Россия и Казахстан ввели в действие новые местные требования послепродажного обслуживания медицинских изделий.
Россия Приказ № 980н «О порядке осуществления контроля безопасности медицинских изделий» для медицинских изделий, зарегистрированных в России. В регламенте описаны критерии мониторинга событий и порядок работы над планом корректирующих мероприятий.
В регламенте описаны критерии мониторинга событий и порядок работы над планом корректирующих мероприятий.
Новое постановление РК (ссылка на русском языке): «О фармаконадзоре и мониторинге безопасности, качества и официальной регистрации медицинских изделий» введено в действие в начале января 2021 г. Документ содержит определение нежелательных явлений, образец формы отчетности, корректирующую — отчет о действиях и уведомление о безопасности в полевых условиях. Сроки для сообщения составляли от 2 до 30 дней, в зависимости от серьезности события.
Новыми требованиями, реализованными в регламенте, являются обязательный пострегистрационный клинический контроль и предоставление ежегодных отчетов по безопасности для устройств класса III и имплантируемых устройств IIB.
Следует отметить, что оба вышеуказанных правила применяются к медицинским изделиям, одобренным местными регистрационными процедурами. При этом пострыночные требования к медицинским изделиям, одобренным в соответствии с евразийским регламентом, описаны в евразийском регламенте №174.
3. Новые правила регистрации производителей медицинских изделий в Казахстане
В январе 2020 года Министерство здравоохранения Казахстана выпустило новые правила проверки производителей медицинских изделий. Это потребовало регистрации медицинских изделий по местной процедуре (ссылка на положение на русском языке).
В соответствии с данным документом проверка системы менеджмента качества (СМК) является обязательной для регистрации стерильных медицинских изделий IIа, IIб и III классов. Это относится к производителям или производственным площадкам, незарегистрированным в Казахстане до или после завершения клинических испытаний для всех имплантируемых устройств класса III и класса IIb. Регламент описывает объем проверки СМК на основе международного стандарта ISO 13485. В некоторых случаях эти новые правила разрешают удаленную проверку в форме оценки документов.
Опубликовано на английском языке
|
Метки: Казахстан, постмаркет, qms, Россия
|
Оставьте ответ
Опубликовано Алексей Степанов
Уважаемые коллеги,
Вот мой обычный список основных моментов по обновлению и развитию нормативно-правовой базы медицинских изделий в России:
- Расширенный перечень медицинских изделий для ускоренной регистрации
2 июня 2020 г. постановлением Правительства Российской Федерации № 804 расширен перечень медицинских изделий, подпадающих под действие упрощенной ускоренной процедуры регистрации медицинских изделий и изделий in vitro, предназначенных для экстренного применения в лечебно-профилактических целях. коронавирусной инфекции (введен в марте 2020 г.). Временное регистрационное удостоверение (сроком действия до конца 2020 года) на отдельные партии таких устройств может быть выдано Росздравнадзором в течение трех рабочих дней после подачи досье.
На сегодняшний день в списке Постановления №804 363 вида медицинских изделий, в том числе некоторые IVD-тесты и лабораторные расходные материалы, аппараты искусственной вентиляции легких и дыхательные контуры, коннекторы и клапаны для ИВЛ, пульсоксиметры, мониторы пациента, медицинская мебель , защитные маски и другие медицинские изделия и средства защиты.
Изделия медицинского назначения одноразового применения, включенные в перечень, могут ввозиться в Россию и выпускаться в обращение без регистрации при условии, что они одобрены в стране происхождения, а сведения о партиях, ввозимых в Россию, представляются в Росздравнадзор.
Постановление также устанавливает новый порядок переоформления и изменения временных регистрационных удостоверений.
- Обновленные Правила регистрации медицинского программного обеспечения в России
9 июня 2020 г. Росздравнадзор опубликовал актуализированное руководство (национальные методические рекомендации) по регистрации программного обеспечения в качестве медицинского изделия в России (ссылка на документ на русском языке).
Документ содержит критерии, по которым ПО может быть отнесено к медицинским изделиям (с примерами), алгоритм классификации со ссылкой на ГОСТ РФ, требования к технической документации на ПО в России, ссылки на законодательство о персональных данных и др. законодательные требования, а также алгоритм технических испытаний, клинических испытаний и оценки компетентным органом.
законодательные требования, а также алгоритм технических испытаний, клинических испытаний и оценки компетентным органом.
Напомним, что в феврале 2020 года Росздравнадзор уже публиковал письмо, разъясняющее некоторые из этих тем.
- Требование об уведомлении о партии для импортеров медицинских изделий в России
Относительно новой инициативой регулирования медицинских изделий в России является требование к производителям и импортерам уведомлять Росздравнадзор о каждой серии и партии медицинских изделий, ввозимых и находящихся в обращении на территории России. Поручение о внесении в срок до 15 июля 2020 года законопроекта, обеспечивающего это требование, было издано Президентом Российской Федерации Владимиром Путиным 24 июня 2020 года. послепродажное наблюдение).
***
Спасибо, что следите за моим блогом, который является некоммерческим проектом, целью которого является предоставление своевременных и четких обновлений о разработке российских и евразийских правил медицинского оборудования.

 Платформа: 1С:Предприятие 8.3 организована по типу архитектуры клиент-сервер.
Платформа: 1С:Предприятие 8.3 организована по типу архитектуры клиент-сервер. На данном этапе произведена автоматизация закупочной деятельности в части годового планирования в соответствии с 223 ФЗ и ЛНА Предприятия.
На данном этапе произведена автоматизация закупочной деятельности в части годового планирования в соответствии с 223 ФЗ и ЛНА Предприятия.